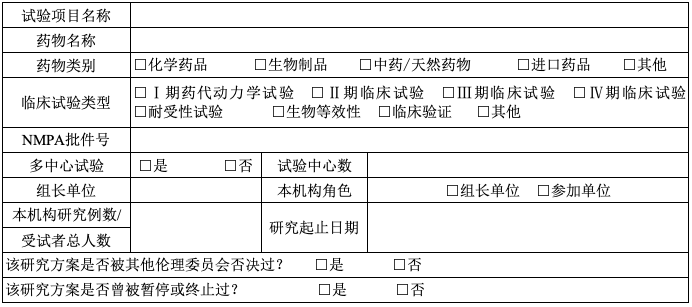
A 项目基本信息
B 申办者信息

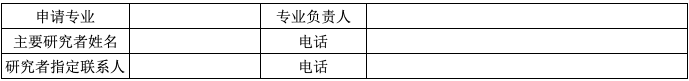
C 主要研究者信息
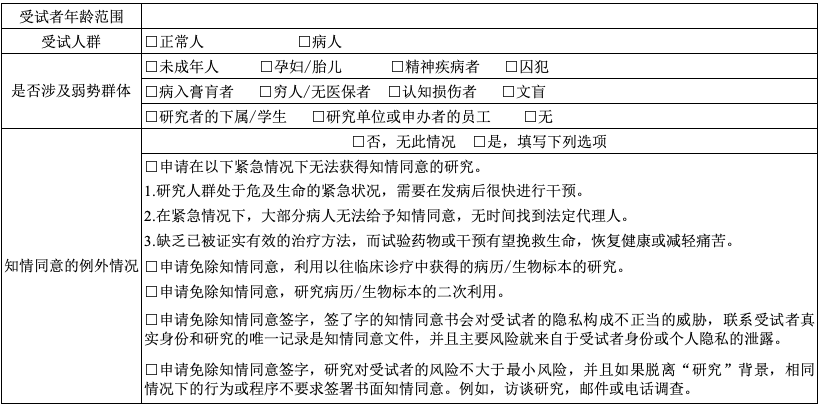
D 招募受试者信息
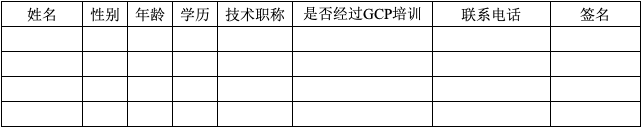
E研究者履历表
F 主要研究者利益冲突声明和签名

附1:递交清单
(在递交资料相应的□内作标记,填写版本号和日期,并按此顺序装订成册)
1. □ 药物临床试验初始审查申请书
2. □主要研究者专业履历及GCP证书复印件1份(最新的)
3. □研究者责任声明(2份)
4. □国家药物临床研究批件(已经上市的药物需提供药物注册证)
5. □中心组长单位伦理批件
6. □其它伦理委员会对申请研究项目的重要决定
7. □药品检验报告
8. □临床试验方案 中文版本号: 日期: 英文版本号: 日期:
9. □知情同意书 中文版本号: 日期: 英文版本号: 日期:
10. □招募受试者广告 中文版本号: 日期:
11. □研究者手册 中文版本号: 日期:
12. □原始病历 中文版本号: 日期:
13. □病例报告表 中文版本号: 日期:
14. □患者日记卡 中文版本号: 日期:
15. □受试者筛选入选表
16. □受试者鉴认代码表
17. □药物发放回收记录表
18. □药品生产许可证
19. □药品GMP证书
20. □申办方营业执照
21. □中华人民共和国组织机构代码证
22. □申办方与CRO公司委托协议
23. □CRO公司营业执照




