一、 初始审查
1、 药物临床试验
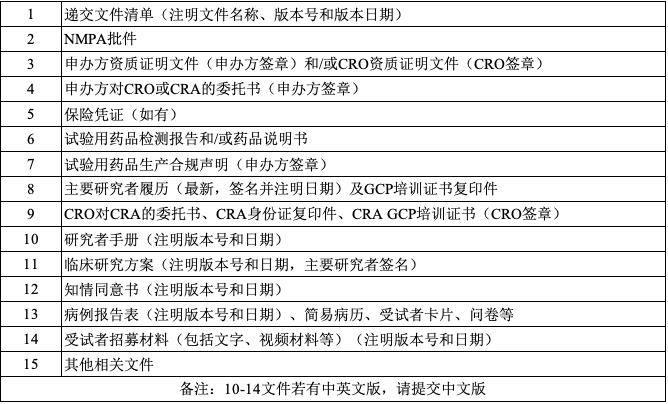
2、 科研与新技术临床研究伦理审查申请文件清单
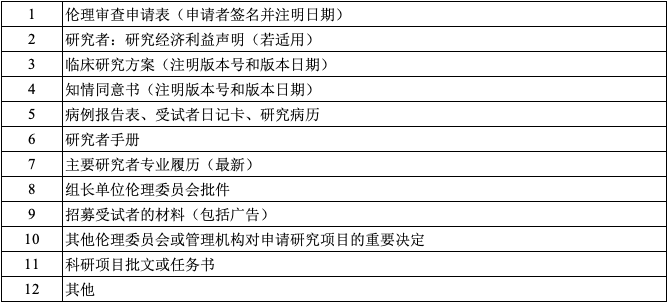
二、 跟踪审查
1、修正案审查申请
a) 修正案审查申请
b) 临床研究方案修正说明页
c) 修正的临床研究方案(注明版本号和版本日期)
d) 修正的知情同意书(注明版本号和版本日期)
e) 修正的招募材料(注明版本号和版本日期)
f) 其他
2、 年度或定期跟踪审查报告
a) 本中心年度或定期跟踪审查报告
b) 多中心临床研究各中心研究进展汇总报告
c) 组长单位伦理委员会的年度或定期跟踪审查的决定文件
d) 其他
3、严重不良事件报告
a) 严重不良事件报告
b) 其他伦理委员会对其中心的非预期药物临床严重不良反应审查意见【适用于外院】
4、违背方案报告
a) 违背方案报告
5、暂停或终止研究报告
a) 暂停或终止研究报告
b) 研究总结报告
6、结题报告
a) 结题报告
三、 复审
a) 复审申请
b) 修正的临床研究方案(注明版本号和版本日期)
c) 修正的知情同意书(注明版本号和版本日期)
d) 修正的招募材料(注明版本号和版本日期)
e) 其他




